 Pesquisadores do Laboratório Nacional de Biociências (LNBio), em Campinas, descobriram um mecanismo molecular envolvido nas alterações das células cardíacas que precedem e determinam o desenvolvimento da insuficiência cardíaca. Os resultados deste trabalho foram publicados no dia 14 de julho na revista científica Structure. A descoberta abre caminho para o desenvolvimento de novos fármacos, capazes de inibir as alterações celulares características da insuficiência cardíaca, de acordo com informações da Assessoria de Comunicação do Laboratório.
Pesquisadores do Laboratório Nacional de Biociências (LNBio), em Campinas, descobriram um mecanismo molecular envolvido nas alterações das células cardíacas que precedem e determinam o desenvolvimento da insuficiência cardíaca. Os resultados deste trabalho foram publicados no dia 14 de julho na revista científica Structure. A descoberta abre caminho para o desenvolvimento de novos fármacos, capazes de inibir as alterações celulares características da insuficiência cardíaca, de acordo com informações da Assessoria de Comunicação do Laboratório. As células do coração com insuficiência apresentam um amplo espectro de alterações morfológicas, incluindo hipertrofia e atrofia, que resultam em redução progressiva da sua capacidade de se contrair e de gerar força para bombear o sangue. Diversos fatores contribuem para as alterações morfológicas dos cardiomiócitos, incluindo excesso de neuro-hormônios (noradrenalina, angiotensina), inflamação e, principalmente, estímulos mecânicos resultantes de forças hemodinâmicas, como hipertensão.
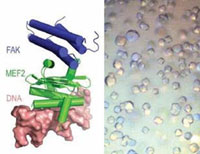
Há muito tempo, suspeita-se que as alterações nos cardiomiócitos são resultantes de uma complexa via, na qual estímulos mecânicos ativam mecanismos moleculares de sinalização que promovem diversos processos, inclusive a expressão de alguns genes, responsáveis finais pelas alterações estruturais e funcionais dos cardiomiócitos na insuficiência cardíaca. “Nosso estudo confirma essa hipótese, descrevendo uma nova rota bioquímica, protagonizada pela enzima conhecida pela sigla FAK, do inglês Focal Adhesion Kinase”, explica Kleber Franchini, coordenador das pesquisas com a FAK e diretor do LNBio.
Localizada no citoplasma, próximo à membrana celular, a FAK é ativada por estímulo mecânico e desloca-se para o núcleo da célula, onde se acopla diretamente a uma proteína reguladora da expressão de genes cardíacos associados ao desenvolvimento de insuficiência cardíaca, conhecida como MEF2 (Myocyte Enhancer Factor 2).
O acoplamento FAK:MEF2 forma um complexo proteico descrito pelos autores com um nível de resolução atômica, permitido pelo uso da técnica de cristalografia de proteínas. Análises da estrutura molecular do complexo FAK:MEF2 abrem possibilidade para o planejamento racional de moléculas capazes de interferir na estabilidade e na atividade do complexo. A expectativa é que a inibição dessa nova rota possa evitar que ocorram alterações morfológicas e funcionais indesejáveis dos cardiomiócitos e resultar em benefícios para pacientes em risco de desenvolvimento de insuficiência cardíaca.
Estudos anteriores, conduzidos pelos autores desta pesquisa e por outros grupos, já haviam demonstrado a importância da FAK e do MEF2 na gênese das alterações morfológicas dos cardiomiócitos na insuficiência cardíaca (leia mais em http://revistapesquisa.fapesp.br/2011/12/26/o-sensor-do-coracao/). “A novidade em nosso trabalho é o estabelecimento do vínculo direto entre os dois sistemas de sinalização, como resultado da ação de estímulos mecânicos”, explica Alisson Cardoso, pesquisador do LNBio.
Para chegar a esse resultado, os pesquisadores de Campinas trabalharam com um conjunto de técnicas sofisticadas que incluíram sistemas miniaturizados para provocar estímulos mecânicos em cardiomiócitos em cultura, imunoprecipitação de cromatina, técnicas de determinação da estrutura de complexos de proteínas por luz síncrotron e imagem por microscopia confocal.
Agência FAPESP



