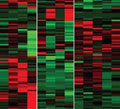
 Ao analisar a expressão gênica de amostras de células sanguíneas de pacientes com três diferentes tipos de diabetes, pesquisadores da Universidade de São Paulo (USP) demonstraram que o transcriptoma de cada uma delas é diferente. Isto é, as células do sistema imune reconhecem as três doenças como problemas distintos. O estudo faz parte do Projeto Temático “Controle do transcriptoma no diabetes mellitus”, iniciado há um ano com o objetivo central de aprofundar a compreensão das bases moleculares da expressão gênica dessa enfermidade. O transcriptoma é o conjunto dos RNAs das células, incluindo os RNAs mensageiros e os microRNAs.
Ao analisar a expressão gênica de amostras de células sanguíneas de pacientes com três diferentes tipos de diabetes, pesquisadores da Universidade de São Paulo (USP) demonstraram que o transcriptoma de cada uma delas é diferente. Isto é, as células do sistema imune reconhecem as três doenças como problemas distintos. O estudo faz parte do Projeto Temático “Controle do transcriptoma no diabetes mellitus”, iniciado há um ano com o objetivo central de aprofundar a compreensão das bases moleculares da expressão gênica dessa enfermidade. O transcriptoma é o conjunto dos RNAs das células, incluindo os RNAs mensageiros e os microRNAs.
O projeto é apoiado pela FAPESP e coordenado por Geraldo Passos, das Faculdades de Odontologia e de Medicina, ambas da USP em Ribeirão Preto.
Passos apresentou os resultados dos estudos durante o 56º Congresso Brasileiro de Genética, realizado entre os dias 14 e 17 de setembro, no Guarujá (SP). A equipe envolvida com o Projeto Temático é formada também por Elza Sakamoto Hojo e Eduardo Antonio Donadi – também professores da USP em Ribeirão Preto –, além de bolsistas e estudantes.
De acordo com Passos, o estudo teve base na análise de amostras do sangue de 60 pacientes, sendo 20 com diabetes tipo 1 (DM1), 20 com diabetes tipo 2 (DM2) e 20 com diabetes gestacional (DMG). O DM1, de caráter autoimune, é herdado geneticamente. O DM2 é provocado por hábitos como ingestão de calorias em demasia e sedentarismo, enquanto o DMG é desenvolvido por determinadas mulheres durante a gravidez.
A partir de amostras de sangue periférico coletadas de pacientes – cada com uma das três formas da doença– , foram separados os linfócitos e depois os RNAs. Os cientistas aplicaram então a técnica de microarrays para avaliar a expressão gênica quanto aos RNAs mensageiros, ou seja, o transcriptoma.
“Construímos um mapa no qual são posicionados tanto os pacientes, considerando as formas da doença, como seus respectivos perfis de expressão dos RNAs mensageiros. Com isso, foi possível mostrar que cada uma das formas da doença tem um transcriptoma diferente. Em outras palavras, os linfócitos do sangue dos pacientes reconhecem as três doenças como sendo distintas. Clinicamente já sabemos fazer essa distinção, mas pela primeira vez mostramos que as diferenças clínicas também se refletem no transcriptoma dos pacientes”, disse Passos à Agência FAPESP.
O objetivo do Temático, de modo geral, inclui não apenas o estudo dos RNAs mensageiros, mas de todo o transcriptoma. De acordo com Passos, isso significa que o próximo passo será a análise dos microRNAs. Ao identificar como um determinado gene atua em uma doença, segundo ele, é possível pensar em desenvolver drogas específicas para tentar atenuar sua expressão – ou estimular a expressão de outros genes na tentativa de controlar a manifestação da doença.
“Estudamos a expressão dos RNAs utilizando a tecnologia dos microarrays para estratificar pacientes com diabetes mellitus. O grande diferencial do projeto é justamente a análise dos três tipos da doença de maneira comparativa, ou melhor, realizando meta-análise dos dados de microarrays. Fazemos isso na perspectiva do transcriptoma dos glóbulos brancos – em especial os linfócitos”, explicou Passos.
Essas células sanguíneas são extremamente sensíveis e, com um mecanismo que conta com receptores em sua superfície, viajam por todo o organismo, “patrulhando” todo tipo de ocorrência, como injúrias, inflamações e traumas físicos.
“Consideramos os linfócitos e outros leucócitos como células repórteres. Quando elas localizam os problemas no sistema, acionam um mecanismo de transdução de sinais que as tornam ativas. Nesse momento podemos recolher essas células e estudar a genética da ativação, descobrindo quais são os genes envolvidos. O objetivo é conhecer a linguagem dessas células repórteres em relação ao transcriptoma”, disse.
É a identificação dos genes associados com a ativação dos linfócidos tidos como células repórteres que permite comparar os transcriptomas. Depois de isolar os linfócitos de pacientes com DM1, por exemplo, os cientistas analisam os seus transcriptomas por meio dos microarrays. Em seguida, o mesmo é feito com o DM2 e o DMG. “Reunimos as informações e, desse modo, podemos identificar as características comuns e divergentes no transcriptoma nas três doenças”, indicou.
Embora seja clinicamente possível diferenciar as três formas da doença, de acordo com Passos, não havia até agora estudos demonstrando que o transcriptoma é distinto em cada uma delas. O grupo conseguiu mostrar que as células repórteres reconhecem o DM1, DM2 e DMG como doenças diferentes.
“É evidente que as três formas compartilham genes, mas o equipamento que usamos, financiado pela FAPESP, permitiu a análise de todo o genoma funcional. Com isso, foi possível estratificar os pacientes e apontar genes que identificam cada uma das doenças”, afirmou.
Embora o projeto tenha começado em setembro de 2009, os estudos partiram de uma base formada em um Projeto Temático anterior, realizado entre 2001 e 2005. No entanto, na época o equipamento disponível para a análise do transcriptoma era muito mais limitado.
“Com a plataforma de microarrays anterior analisávamos 10% dos genes a que temos acesso hoje. Podemos dizer que tivemos um incremento de 90% em nosso desempenho. O processo todo era mais lento e exigia mais RNA dos pacientes. Nesses dez anos a tecnologia genômica avançou muito. A FAPESP reconheceu isso e tem nos apoiado”, afirmou.
Mecanismos de controle
Os exames clínicos já são suficientes para classificar o DM1, DM2 e DMG como doenças diferentes, de acordo com Passos. No entanto, o estudo do transcriptoma é necessário para que se possa compreender o mecanismo de controle molecular que leva a essa distinção.
“A clínica é capaz de observar o fenótipo e identificar o tipo de diabetes. Mas a análise clínica não oferece muitas perspectivas para interferir na manifestação da doença. Por isso precisamos começar a analisar e compreender o que controla o fenótipo: qual das formas do diabetes está mais associada à genética – ao controle do transcriptoma – ou ao ambiente”, disse.
A questão, portanto, é saber o que torna cada tipo de diabetes diferente nos seus respectivos transcriptomas. “Se soubermos que gene está ativo ou inativo quando cada uma das formas da doença se manifesta, já começamos a nos aproximar dos mecanismos de controle. Demos um passo importante nessa direção. O que conseguimos não é trivial, mas se trata de uma pesquisa que ainda tem um longo caminho pela frente”, explicou.
Em um trabalho que ainda está em fase de redação, Diane Rassi, uma das pesquisadoras do grupo, separou as células sanguíneas dos pacientes de DM1 em linfócitos B, linfócitos T e monócitos. A partir daí, estudou o transcriptoma de cada uma dessas células isoladamente, em vez dos linfócitos totais, a fim de identificar qual delas apresenta uma resposta mais precisa.
“Temos interesse em saber qual dessas células é a mais sensível – qual tem maior potencial para ser utilizada como célula repórter. Segundo nossos resultados, tanto os linfócitos totais como os tipo isolados, quando analisados por microarrays , permitem estratificar os pacientes de forma eficiente", disse Passos.
“Esse é um achado original que tem um caráter prático importante. Se no futuro essa tecnologia chegar aos laboratórios de análises clínicas – nos quais os médicos precisam de respostas rápidas, diferentemente dos laboratórios de pesquisa científica –, será interessante trabalhar com os linfócitos totais. Por isso, queremos saber se ao usar linfócitos totais chegaremos à mesma resposta que tivemos com as células separadas”, disse.
Além dos estudos a partir de amostras colhidas em pacientes, o grupo também realiza pesquisas experimentais com camundongos NOD (diabéticos não-obesos, na sigla em inglês), que possuem semelhança genética significativa com o ser humano. Essa linhagem mutante também desenvolvem o DM1 a partir dos seis meses de idade.
“É um modelo experimental que nos permite interferir no processo. Há certos tipos de estudos que só podem ser feitos em camundongos. Por exemplo, um gene ligado à doença pode iniciar sua manifestação ainda na fase fetal, o que só podemos analisar mais facilmente nos animais”, explicou.
Outro foco do grupo é estudar o transcriptoma para descobrir genes candidatos que possam ser usados como biomarcadores da emergência da doença. Segundo Passos, a literatura na área de imunogenética indica marcadores bem definidos apenas para DM1.
O professor explica que determinados alelos de genes do sistema HLA (Antígenos de Leucócitos Humanos, na sigla em inglês) determinam a suscetibilidade ao DM1. Se uma criança é portadora de um desses alelos de HLA, muito provavelmente desenvolverá a doença até a adolescência.
“Os alelos HLA são biomarcadores para DM1. Mas não temos biomarcadores para DM2 ou DMG. Descobrir marcadores de manifestação precoce dessa forma da doença é fundamental para melhorar seu controle. Para localizar esses marcadores, vamos precisar da ajuda das células repórteres. Estamos identificando essas células e tentando entender sua linguagem”, disse.
Agência FAPESP



